Como escolher um ensaio de viabilidade celular ou de citotoxicidade
Este guia descreve como funcionam os ensaios de viabilidade celular e citotoxicidade e fornece informações para o ajudar a selecionar o ensaio de saúde celular adequado às suas necessidades. Visite a lista de produtos de Ensaios de Viabilidade Celular e Citotoxicidade para obter informações sobre encomendas dos ensaios aqui abordados.
Johanna Lee e Mariel Mohns
Promega Corporation
Data de publicação: 06/2019; tpub_209
Escolher um cell viability or cytotoxicity assay de entre as muitas opções diferentes disponíveis pode ser uma tarefa difícil. Identificar o melhor método de ensaio de saúde celular para satisfazer as suas necessidades requer uma compreensão do que cada ensaio está a medir como marcador, como a medição se correlaciona com a viabilidade celular e quais são as limitações dos produtos químicos do ensaio. Também tem a opção de multiplexar ensaios compatíveis para obter mais dados com uma vantagem estatística.
Aqui fornecemos uma visão geral dos ensaios de viabilidade celular e citotoxicidade da Promega que utilizam métodos de deteção baseados em leitores de placas e protocolos fáceis de "adicionar-misturar-medir". Este guia também inclui factores chave a considerar na escolha de ensaios de saúde celular, para que possa comparar sensivelmente os dados de poço para poço, placa para placa e no dia a dia.
Veja como os ensaios baseados em células podem ser utilizados para medir o número de células vivas, células mortas e células em processo de apoptose, autofagia ou stress oxidativo em culturas de células.

Introdução aos ensaios de viabilidade celular
Os ensaios de viabilidade celular utilizam uma variedade de marcadores como indicadores de células metabolicamente activas (vivas). Exemplos de marcadores normalmente utilizados incluem a medição dos níveis de ATP, a medição da capacidade de reduzir um substrato e a deteção de actividades enzimáticas/proteases exclusivas das células vivas.
Ensaios de viabilidade celular em tempo real
O RealTime-Glo™ MT Cell Viability Assay (Cat.# G9711) mede a viabilidade celular em tempo real. Neste ensaio, uma luciferase modificada e um prosubstrato (que não é um substrato da luciferase) são adicionados diretamente ao meio de cultura. O prosubstrato pode penetrar nas membranas celulares e entrar nas células (Figura 1). No entanto, apenas as células viáveis com metabolismo ativo podem reduzir o prossubstrato a um substrato para a luciferase. O substrato sai então da célula onde é utilizado pela luciferase no reagente de deteção para gerar um sinal luminescente. Os mesmos poços podem ser medidos repetidamente durante 3 dias. As principais vantagens deste método são o facto de permitir uma monitorização cinética simples para determinar a resposta à dose utilizando menos placas e células. Além disso, como o método não exige a lise das células, as mesmas células podem ser utilizadas em ensaios adicionais baseados em células ou em aplicações a jusante.
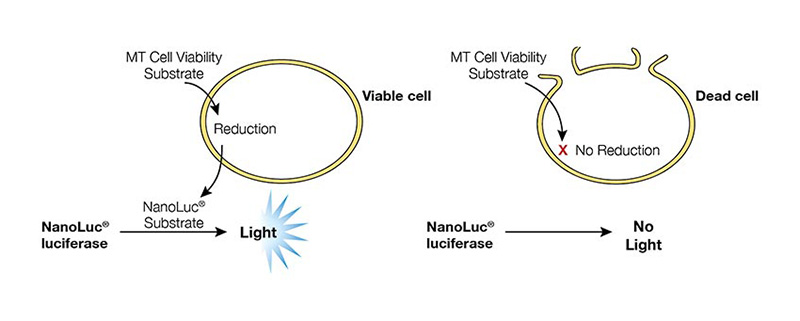
Figura 1. Descrição geral do Ensaio de Viabilidade Celular RealTime-Glo™ MT.
Ensaios de viabilidade celular com ATP
O ATP pode ser utilizado para medir a viabilidade celular, uma vez que apenas as células viáveis podem sintetizar ATP. O ATP pode ser medido utilizando o CellTiter-Glo® Luminescent Cell Viability Assay (Cat.# G7570) com reagentes que contêm detergente, luciferase estabilizada e substrato de luciferina. O detergente lisa as células viáveis, libertando ATP para o meio. Na presença de ATP, a luciferase utiliza a luciferina para gerar luminescência, que pode ser detectada em 10 minutos utilizando um luminómetro (Figura 2). O CellTiter-Glo® 2.0 Assay (Cat.# G9241) é fornecido como uma solução única que reduz o tempo de preparação do reagente e proporciona a conveniência de armazenamento à temperatura ambiente para uma implementação fácil. Estes ensaios de ATP são mais rápidos do que outros métodos, uma vez que não requerem longos tempos de incubação para converter um substrato num produto colorido. Têm também uma excelente sensibilidade e uma linearidade alargada, o que os torna altamente compatíveis com aplicações de elevado rendimento em que são utilizados números reduzidos de células. São também menos propensos a artefactos do que outros métodos.

Figura 2. O ensaio CellTiter-Glo® detecta ATP como um indicador de células viáveis.
Ensaio de viabilidade de protease em células vivas
A atividade da protease em células vivas desaparece rapidamente após a morte celular, pelo que é um marcador útil de células viáveis. Utilizando o CellTiter-Fluor™ Cell Viability Assay (Cat.# G6080), a atividade da protease de células vivas pode ser medida utilizando um substrato de protease fluorogénico permeável às células (GF-AFC). O substrato entra nas células vivas onde é clivado pela protease de células vivas para gerar um sinal fluorescente proporcional ao número de células viáveis (Figura 3). O tempo de incubação para este método é de 0,5-1 hora, o que é mais curto do que os ensaios de tetrazólio (1-4 horas). Uma vez que este método não lise as células, permite a multiplexagem com muitos outros ensaios nos mesmos poços de amostra, incluindo ensaios bioluminescentes baseados em células repórteres.
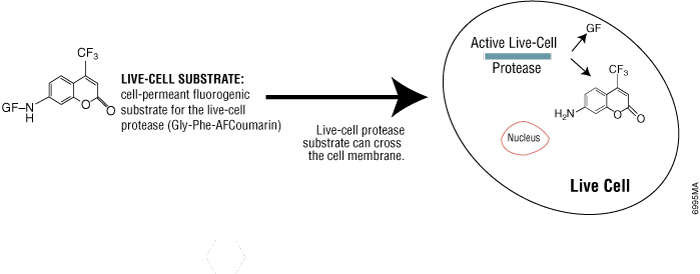
Ensaios de Viabilidade Celular com Redução de Tetrazólio
Os compostos de tetrazólio utilizados para detetar células viáveis dividem-se em duas categorias básicas:
Compostos com carga positiva (MTT) que penetram facilmente nas células viáveis:
As células viáveis com metabolismo ativo são capazes de converter o MTT num produto formazan de cor púrpura. Assim, a formação de cor pode ser um marcador útil de células viáveis. O CellTiter 96® Non-Radioactive Cell Proliferation Assay (MTT) (Cat.# G4000) utiliza esta química. No entanto, o tempo de incubação para este método é longo (normalmente 4 horas). Além disso, o produto formazan é insolúvel, pelo que deve ser adicionado um reagente solubilizante antes de registar as leituras de absorvância.
Compostos de carga negativa (MTS, XTT, WST-1) que não penetram nas células:
Quando se utiliza o CellTiter 96® AQueous One Solution Cell Proliferation Assay (MTS) (Cat.# G3582), os compostos de carga negativa devem ser combinados com reagentes intermediários de acoplamento de electrões, que podem penetrar nas células, ser reduzidos e depois sair da célula para converter o tetrazólio no produto solúvel formazan. O tempo de incubação para este método é de 1–4 horas. Não é necessário adicionar um reagente solubilizante, uma vez que o formazan resultante é solúvel, tornando-o mais conveniente.
Ensaio de redução da viabilidade celular com resazurina
A resazurina é um corante indicador permeável às células, de cor azul escura com pouca fluorescência intrínseca. O CellTiter-Blue® Cell Viability Assay (Cat.# G8080) utiliza a resazurina para medir a viabilidade celular. Apenas as células viáveis com metabolismo ativo podem reduzir a resazurina em resorufina, que é rosa e fluorescente. Após 1–4 horas de incubação, o sinal é quantificado utilizando um espetrofotómetro de microplacas ou um fluorómetro. Este método é relativamente barato e mais sensível do que os ensaios de tetrazólio. No entanto, a fluorescência dos compostos que estão a ser testados pode interferir com as leituras da resorufina.
Uma desvantagem de todos os ensaios de redução de tetrazólio ou resazurina é o facto de dependerem da acumulação de produtos coloridos ou fluorescentes ao longo do tempo. Uma vez que o sinal aumenta gradualmente ao longo do tempo, não é possível detetar uma diminuição da viabilidade celular durante esta longa incubação.
Introdução aos ensaios de citotoxicidade
Um dos principais eventos que ocorrem após a morte celular é a perda da integridade da membrana, que permite que substâncias químicas ou proteínas entrem ou saiam livremente da célula. Apresentamos aqui ensaios de citotoxicidade que avaliam a presença de células mortas através da deteção da saída de certas proteínas (protease de células mortas, lactato desidrogenase) ou do influxo de produtos químicos (corante de ADN).
Ensaio de citotoxicidade de libertação de protease de células mortas
Quando as células morrem e perdem a integridade da membrana, são libertadas proteases de células mortas. Um substrato luminogénico (CytoTox-Glo™ Cytotoxicity AssayG9290) ou substrato fluorogénico (CytoTox-Fluor™ Cytotoxicity AssayG9260) pode então ser utilizado para medir a atividade das proteases de células mortas (Figura 4). Uma vez que o substrato não é permeável às células, essencialmente nenhum sinal deste substrato é gerado por células intactas e viáveis. Além disso, uma vez que os ensaios são não-líticos, podem ser combinados com outros produtos químicos de ensaio compatíveis.
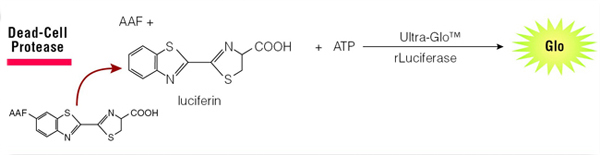
Figura 4. O ensaio CytoTox-Glo® detecta a libertação de protease após a morte celular.
Ensaios de citotoxicidade de libertação de lactato desidrogenase (LDH)
As células mortas que perderam a integridade da membrana libertam lactato desidrogenase (LDH), que catalisa a conversão de lactato em piruvato com a produção concomitante de NADH. A atividade da LDH libertada pode ser medida fornecendo substratos em excesso (lactato e NAD) para produzir NADH. Este NADH pode ser medido utilizando diferentes produtos químicos de ensaio:
1. LDH-Glo™ Ensaio de citotoxicidade
No LDH-Glo™ Cytotoxicity Assay (Cat.# J2380), a redutase utiliza NADH e o substrato da redutase (proluciferina) para gerar luciferina. A luciferina é medida utilizando uma luciferase patenteada e o sinal luminoso é proporcional à quantidade de LDH, medida por um luminómetro.

2. CytoTox-ONE™ Ensaio de integridade da membrana homogénea
O CytoTox-ONE™ Homogeneous Membrane Integrity Assay (Cat.# G7890): Conversão da resazurina num produto fluorescente de resorufina, medido com um fluorómetro.

Figura 6. O ensaio CytoTox-ONE™ detecta a redução da resazurina a um produto fluorescente, a resorufina.
3. CytoTox 96® Ensaio de citotoxicidade não radioativo
O ensaio CytoTox 96® Non-Radioactive Cytotoxicity Assay (Cat.# G1780) detecta a conversão de um sal de tetrazólio (INT) num produto de formazan vermelho, medido pela absorvância da cor

Figura 7. O ensaio CytoTox-96® detecta a conversão de um sal de tetrazólio (INT) num produto de formazan vermelho.
Ensaio de Citotoxicidade de Corantes de ADN
Alguns corantes de ligação ao ADN são excluídos das células vivas, mas podem entrar e corar o ADN de células mortas permeáveis. Os corantes convencionais, como o azul de tripano, requerem frequentemente a contagem manual das células coradas utilizando um hemocitómetro, o que é trabalhoso e não é facilmente escalável. Outra desvantagem dos corantes convencionais é o facto de poderem ser tóxicos para as células e só poderem ser utilizados para a medição de pontos finais.
Os corantes mais recentes, como o CellTox™ Green Dye, produzem um sinal fluorescente quando se ligam ao ADN, que é facilmente medido com um fluorómetro. Pode ser diluído em meio de cultura e administrado diretamente às células aquando da sementeira ou do tratamento com um composto de teste, permitindo a medição cinética em tempo real. O CellTox™ Green Cytotoxicity Assay (Cat.# G8741) não é tóxico, é altamente foto-estável e facilmente escalável.
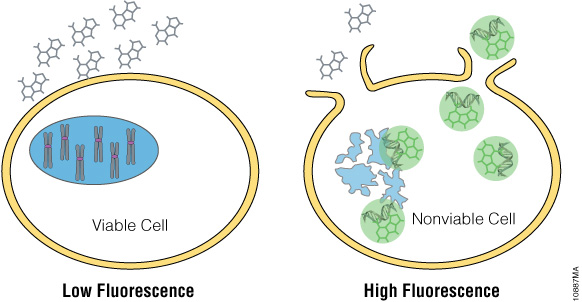
Figura 8. CellTox™ Green detecta o ADN libertado pelas células mortas com um corante fluorescente de ligação ao ADN.
Como escolher um ensaio de saúde celular
A escolha de um ensaio de saúde celular pode ser uma tarefa difícil. Aqui apresentamos uma série de factores a considerar ao escolher ensaios baseados em células para sistemas manuais ou automatizados.
O que pretende medir?
Que células, viáveis ou mortas, pretende detetar no final de uma experiência? Existem ensaios de saúde celular disponíveis que detectam especificamente o número de células vivas (ensaios de viabilidade), o número de células mortas (ensaios de citotoxicidade) e para avaliar o mecanismo de morte celular (ensaios de apoptose). Se a informação pretendida for simplesmente confirmar se existe uma diferença entre os controlos negativos "sem tratamento" e o "tratamento com toxina" dos poços experimentais, a escolha entre medir o número de células viáveis ou o número de células mortas pode ser irrelevante. No entanto, se se pretender obter informações mais pormenorizadas sobre o mecanismo de morte celular, a duração da exposição à toxina, a concentração do composto de ensaio e a escolha do parâmetro do ensaio tornam-se críticas (1). Explore as seguintes considerações para o ajudar a determinar o que pretende medir e quais os ensaios que o podem ajudar.
Qual é o seu sistema modelo?
As espécies de origem e os tipos de células utilizados nos estudos de saúde celular são frequentemente ditados por objectivos específicos do projeto ou pelo alvo do medicamento que está a ser investigado. Independentemente do sistema modelo escolhido, é importante estabelecer um procedimento consistente e reprodutível para a cultura de células e a preparação de placas de ensaio. A variação do número de células por poço ou do período de equilíbrio antes da realização do ensaio pode afetar a fisiologia celular. A manutenção e o manuseamento de culturas de células de reserva em cada fase do processo devem ser normalizados e validados quanto à consistência. Além disso, certifique-se de que utiliza controlos positivos e negativos conhecidos ao longo da experiência para estabelecer uma compreensão geral do estado fisiológico das células. Uma vez que a natureza da amostra pode variar consoante o tipo de célula e o facto de se tratar de um modelo de cultura 2D ou 3D, o procedimento de ensaio deve ser validado para cada sistema de modelo de cultura. Um sistema modelo que exija a utilização de um número mais reduzido de células, como é o caso das células primárias ou de outros tipos de células limitados, exigirá um ensaio com maior sensibilidade.
Está a utilizar culturas de células 2D ou 3D?
As células em cultura são apenas um sistema modelo e são diferentes das células no seu ambiente normal in vivo. Muitos investigadores estão agora a utilizar culturas de células 3D para imitar mais de perto as condições in vivo. Em vez de crescerem numa monocamada na superfície de uma placa, as células em cultura 3D crescem numa conformação que lhes permite interagir umas com as outras, formando ligações célula:célula. Esta complexidade acrescida pode apresentar desafios para a conceção experimental aquando da realização de ensaios baseados em células, uma vez que os reagentes dos ensaios podem ter dificuldade em chegar ao centro de microtecidos de grandes dimensões e os ensaios líticos podem não ser capazes de romper todas as células do sistema 3D. Os ensaios podem ter de ser optimized for 3D systems , reformulando os reagentes com detergentes mais fortes e incorporando a rutura mecânica e tempos de incubação mais longos. Os ensaios colorimétricos, como o MTT, não são ideais para utilização em culturas de células 3D porque têm uma capacidade limitada de penetrar em várias camadas de células.
O CellTiter-Glo® 3D Cell Viability Assay (Cat.# G9681) foi especificamente concebido para determinar a viabilidade celular em modelos de cultura 3D. O reagente de ensaio tem uma maior capacidade lítica - permitindo uma melhor penetração em amostras de esferóides grandes, resultando numa determinação mais exacta da viabilidade em comparação com outros métodos de ensaio. O reagente de ensaio CellTiter-Glo® 3D mede o ATP como indicador de viabilidade e gera uma leitura luminescente que é muito mais sensível do que os métodos colorimétricos ou baseados na fluorescência.
Para medir a citotoxicidade de um composto, o LDH-Glo™ Cytotoxicity Assay (Cat.# J2380) é ideal para utilização com modelos de cultura 3D. Em vez de se basear na penetração da membrana celular, o ensaio mede a libertação de LDH das células mortas para o meio. O ensaio requer apenas a remoção de pequenos volumes de meio (2-5µl), permitindo a amostragem repetida ao longo do tempo. Isto conserva os microtecidos e mantém as células viáveis remanescentes, permitindo-lhe utilizar as amostras para aplicações adicionais a jusante, com outros ensaios, ou para análise de ácido nucleico para obter mais dados utilizando as mesmas amostras.
Quando é a altura certa para efetuar um ensaio de saúde celular?
A correspondência entre o marcador de ensaio detectado e a informação de que necessita é vital para a escolha do ensaio de saúde celular adequado. Uma compreensão básica das alterações que ocorrem durante os diferentes mecanismos de morte celular ajudá-lo-á a decidir qual o ensaio a escolher. A Figura 9 mostra um exemplo simplificado que ilustra as alterações cronológicas que ocorrem durante a apoptose e a necrose e os resultados que seriam esperados utilizando ensaios que medem diferentes marcadores.

Figura 9. Os mecanismos de morte celular podem ser determinados através da medição de diferentes marcadores de viabilidade celular, citotoxicidade e apoptose in vitro.
As células que sofrem necrose sofrem tipicamente um rápido inchaço, perdem a integridade da membrana, interrompem o metabolismo e libertam o seu conteúdo citoplasmático para o meio de cultura circundante. As células que sofrem necrose rápida in vitro não têm tempo ou energia suficientes para ativar a maquinaria apoptótica e não expressam marcadores apoptóticos.
Medição da apoptose e da necrose
As células cultivadas que estão a sofrer apoptose in vitro acabam por sofrer necrose secundária. Após um período de incubação prolongado, as células apoptóticas acabam por parar o metabolismo, ativar as caspases, lançar a fosfatidilserina (PS) para a membrana externa, perder a integridade da membrana e libertar o seu conteúdo citoplasmático para o meio de cultura. Os marcadores de apoptose, como a atividade das caspases ou a exposição da PS na superfície celular, podem estar presentes apenas transitoriamente. Por conseguinte, para determinar o mecanismo primário de morte celular, é fundamental compreender a cinética do processo de morte celular no seu sistema modelo. Para evitar perder um ponto de tempo crítico, pode optar por um ensaio em tempo real não-lítico, como o RealTime-Glo™ Annexin V Apoptosis and Necrosis Assay (Cat.#JA1011), que permite leituras repetidas de um único poço de ensaio ao longo do tempo.
Necessita de recolher dados de vários pontos temporais?
Live-cell kinetic assays Os reagentes de deteção são reagentes que permitem que o mesmo poço de amostra seja medido repetidamente em vários pontos de tempo. Isto poupa-lhe tempo e esforço, permitindo-lhe recolher dados mais informativos em tempo real. Se precisar de efetuar experiências de resposta a tempo e dose para determinar o início ou o mecanismo de toxicidade de um fármaco, é provável que beneficie de um ensaio em tempo real. Especialmente se estiver a utilizar amostras de células limitadas ou preciosas, é fundamental obter o máximo de dados possível da sua amostra. A Promega fornece um portfolio of assays capaz de determinar a saúde celular cinética de células vivas.
O RealTime-Glo™ MT Cell Viability Assay (Cat.# G9711) permite-lhe monitorizar continuamente a viabilidade celular na mesma amostra até 72 horas, dependendo do número de células. O ensaio mede o potencial redutor das células viáveis e é independente do ATP, proporcionando um método ortogonal para a determinação da viabilidade. O RealTime-Glo™ Annexin V Apoptosis and Necrosis Assay (Cat.# JA1011) é um método baseado num leitor de placas que mede a exposição em tempo real da fosfatidilserina (PS) no folheto exterior das membranas celulares durante o processo apoptótico. A combinação e o momento dos sinais luminescentes (apoptóticos) e fluorescentes (necróticos) são utilizados para diferenciar a necrose secundária da necrose causada por outros eventos citotóxicos. O CellTox™ Green Cytotoxicity Assay (Cat.# G8741) utiliza um corante que produz um sinal fluorescente quando ligado ao ADN em células com membrana comprometida. Este ensaio pode ser aplicado diretamente às células durante a sementeira ou durante o tratamento com um composto de teste em qualquer momento de incubação, permitindo a medição cinética em tempo real do início da citotoxicidade.
Uma vez que estes ensaios não são tóxicos nem líticos, as restantes células viáveis permanecem intactas para aplicações adicionais a jusante, resultando em mais dados por amostra.
Quantas amostras são necessárias para testar?
Se apenas for necessário medir uma ou algumas amostras, a contagem manual de células vivas ou mortas utilizando um hemacitómetro pode ser adequada. Os métodos de imagiologia ou de citometria de fluxo também são úteis para um número reduzido de amostras, mas são menos adequados para aplicações de elevado rendimento. Se for medido um grande número de amostras, os ensaios homogéneos que não requerem lavagens celulares ou passos de centrifugação são os mais eficientes. Além disso, o tempo necessário para a preparação e incubação dos reagentes deve ser mínimo. A estabilidade do sinal de absorvância, fluorescência ou luminescência é outro fator importante que proporciona comodidade e flexibilidade no registo de dados e minimiza a variabilidade ao processar grandes lotes de placas. Para o rastreio de milhares de amostras, é vantajoso escolher ensaios que sejam suficientemente sensíveis para permitir a miniaturização em formatos de placas de alta densidade (placas de 384 ou 1536 poços).
A Promega produz uma vasta gama de ensaios de saúde celular baseados em leitores de placas que são rápidos, altamente sensíveis, simples e compatíveis com medições de elevado rendimento (2). Embora o protocolo geral para a maioria destes ensaios "homogéneos" seja adicionar-misturar-medir, alguns protocolos podem exigir passos de transferência, incubação ou agitação. Recomendamos a revisão completa dos protocolos de ensaio para determinar se o fluxo de trabalho satisfaz as suas necessidades.
Encontre o ensaio certo para as suas necessidades
Clique em baixo para comparar a variedade de ensaios em placas da Promega concebidos para medir a viabilidade celular, a citotoxicidade e a apoptose.
Que tipo de sensibilidade é necessária?
Outro fator a considerar ao selecionar um ensaio é a sensibilidade da deteção. A sensibilidade necessária está intimamente ligada ao número de células utilizadas por amostra. Em geral, os ensaios luminescentes são mais sensíveis do que os ensaios baseados na deteção da fluorescência ou da absorvância, porque a luminescência de fundo mínima resulta em rácios sinal-ruído elevados. Com a deteção de fluorescência, a fluorescência inerente das células, a fluorescência composta e a sobreposição espetral entre os comprimentos de onda de excitação e de emissão podem resultar em relações sinal-ruído reduzidas.
A sensibilidade da deteção varia consoante o tipo de célula, se optar por medir um marcador metabólico, como o nível de ATP ou a redução de tetrazólio MTS. Os rácios sinal-fundo de alguns ensaios podem ser melhorados aumentando o tempo de incubação. A sensibilidade do reagente de deteção depende de ambos os parâmetros do sistema modelo, como o formato da placa e o número de células por poço, para além do parâmetro que está a ser avaliado, como a diminuição da viabilidade celular. Os ensaios concebidos para detetar uma alteração na viabilidade numa população de 10.000 células podem não exigir a tecnologia de ensaio mais sensível. Por exemplo, um ensaio de tetrazólio como o CellTiter 96® Non-Radioactive Cell Proliferation Assay (Cat.# G4000) deve detetar facilmente a diferença entre 10.000 e 8.000 células viáveis. Por outro lado, os sistemas de modelos de ensaio que utilizam números baixos de células num formato de placa multipoços de alta densidade podem exigir uma sensibilidade máxima de deteção, como a obtida com o CellTiter-Glo® Luminescent Cell Viability Assay (Cat.# G7570) que pode facilmente detetar menos de 100 células.
Quão estáveis são os reagentes?
Para os investigadores que utilizam plataformas de rastreio automatizadas de elevado rendimento, a estabilidade dos reagentes e a compatibilidade com os componentes robóticos são frequentemente uma preocupação. Os reagentes do ensaio devem ser estáveis à temperatura ambiente durante um período de tempo adequado para completar a dispensa em várias placas. Além disso, o sinal gerado pelo ensaio deve ser estável durante longos períodos de tempo para permitir flexibilidade no registo de dados, quer consecutivamente, quer no processamento em modo de lote. O Ensaio de Viabilidade Celular CellTiter-Glo® 2.0 foi formulado para permitir o armazenamento à temperatura ambiente durante vários dias e gera um sinal luminescente estável com uma semi-vida que permite o processamento em lote.
Que instrumentos são necessários?
Em alguns casos, a escolha do ensaio pode ser ditada pela disponibilidade de instrumentos para detetar a absorvância, a fluorescência ou a luminescência. A nossa carteira de ensaios contém um formato de deteção opcional para cada uma das três principais classes de ensaios de saúde celular (viabilidade, citotoxicidade ou apoptose). Para além disso, os resultados de alguns ensaios, como o CellTiter-Glo®Luminescent Cell Viability Assay (Cat.# G7570) podem ser registados com mais do que um tipo de instrumento (luminómetro ou câmara CCD).
Descubra o instrumento certo para si
Os instrumentos de leitura de microplacas GloMax® são sistemas de deteção modulares e fáceis de utilizar que oferecem uma maior flexibilidade na conceção das suas experiências de ensaio em placas. Estes instrumentos funcionam na perfeição com os ensaios da Promega, tendo protocolos pré-carregados para uma deteção fácil e rápida.
Que placas são adequadas para utilizar?
Ao utilizar os nossos ensaios baseados em placas, a escolha do tipo correto de placa depende das suas necessidades de investigação. Se for desejada a observação microscópica das células, são necessárias placas opacas de fundo transparente.
Em geral, as placas pretas opacas são utilizadas para reduzir o fundo dos ensaios fluorescentes e as placas brancas opacas são utilizadas para obter uma saída de luz óptima para os ensaios luminescentes. No entanto, a intensidade do sinal da maioria dos ensaios luminescentes é adequada, pelo que podem ser utilizadas placas pretas. A utilização de placas pretas para ensaios luminescentes proporciona a maior flexibilidade para a multiplexagem de ensaios fluorescentes e luminescentes a partir da mesma amostra. As placas transparentes são aceitáveis para utilização com ensaios colorimétricos, mas não devem ser utilizadas com ensaios fluorescentes ou luminescentes. A escolha do instrumento e das placas correctas pode ajudá-lo a reduzir a interferência e outros problemas que podem confundir os seus dados.
Pretende efetuar mais do que um ensaio com a sua amostra (multiplex)?
A multiplexagem de mais do que um ensaio é uma abordagem versátil que pode fornecer mais informações a partir de uma única amostra. Por exemplo, pode medir simultaneamente os eventos da via de resposta ao stress celular e o mecanismo de morte celular no mesmo poço de amostra, ou medir a viabilidade celular com resposta repórter para normalizar os resultados em relação ao número de células vivas. A multiplexagem requer a compatibilidade dos produtos químicos de ensaio utilizados e a capacidade de distinguir sinais separados utilizando diferentes comprimentos de onda de deteção ou detectando diferentes modalidades, como a fluorescência e a luminescência. Para produtos químicos de ensaio compatíveis, a multiplexagem pode ser efectuada simultaneamente no mesmo poço de amostra. Para algumas combinações de ensaios, as medições devem ser efectuadas de forma sequencial. Ainda outras opções de multiplexagem podem ser activadas separando uma parte da amostra num recipiente diferente para ultrapassar a incompatibilidade química do ensaio, os requisitos do instrumento ou o formato da placa (por exemplo, plástico transparente vs. plástico opaco). Por exemplo, a placa LDH-Glo™ Cytotoxicity Assay (Cat.# J2380) oferece a oportunidade de reunir vários pontos de dados removendo pequenas alíquotas de sobrenadante de cultura para uma placa de ensaio opaca branca, deixando assim a placa de ensaio original contendo células disponíveis para outros ensaios, tais como análise de genes repórter, análise de imagem, análise de ácido nucleico, etc.
A multiplexagem de ensaios no poço de amostra elimina a necessidade de múltiplas amostras paralelas para diferentes ensaios e pode poupar tempo, esforço e custos, bem como proporcionar uma vantagem estatística em comparação com a utilização de amostras paralelas. Vários dos nossos ensaios homogéneos de citotoxicidade, apoptose e viabilidade podem ser multiplexados sem transferência de meios, permitindo aos investigadores ensaiar vários parâmetros no mesmo poço de amostra.
Exemplo de protocolos de multiplexagem:
- Interpreting Multiplexing Data Using the CellTox™ Green Cytotoxicity Assay
- An Introduction to Real Time Cell Viability Measurement
- Perform Multiplexed Cell-Based Assays on Automated Platforms
- Multiplexing Homogeneous Cell-Based Assays
O ensaio é reprodutível?
A reprodutibilidade dos dados é uma consideração importante quando se escolhe um ensaio comercial. No entanto, para a maioria dos ensaios baseados em células, é mais provável que a variação entre amostras replicadas seja causada pelas células do que pela química do ensaio. As variações durante o plaqueamento de células podem ser ampliadas pela utilização de linhas celulares que tendem a formar aglomerados em vez de uma suspensão de células individuais. Períodos de incubação prolongados e efeitos de borda nas placas também podem levar a uma diminuição da reprodutibilidade entre réplicas e a valores menos desejáveis do fator Z’(2). Ao escolher um ensaio, é fundamental compreender as causas da variabilidade dos resultados.
Qual é o custo?
Normalmente, existe um compromisso entre o custo do reagente e a qualidade do ensaio ou a conveniência que este proporciona ao utilizador. Os reagentes menos dispendiosos têm frequentemente procedimentos mais complexos, sensibilidade limitada ou causam toxicidade nas células em cultura devido a incubações mais longas e demoram mais tempo a efetuar. Apesar destas desvantagens gerais, pode haver muitas aplicações em que os ensaios menos dispendiosos são adequados; no entanto, deve ter-se o cuidado de evitar reagentes que sejam citotóxicos, uma vez que podem afetar os resultados do ensaio ou limitar a capacidade de multiplexar com outros ensaios.
Os reagentes e kits de ensaio comercialmente disponíveis com controlo de qualidade são geralmente mais caros, mas poupam frequentemente tempo e custos a longo prazo, evitando experiências repetidas ou resultados não replicáveis. Por exemplo, embora o custo dos reagentes de um ensaio de viabilidade celular com ATP possa ser superior ao de outros ensaios, a rapidez (poupança de tempo), a sensibilidade (poupança de amostras de células) e a exatidão (confiança nos dados) podem compensar o custo inicial. Os ensaios com boa sensibilidade de deteção e mais fáceis de reduzir para os formatos de 384 ou 1536 poços podem resultar em poupanças de reagentes de cultura celular e permitir o ensaio de quantidades muito pequenas de compostos de ensaio e tipos de amostras caros ou raros, especialmente células primárias. Os ensaios capazes de efetuar medições em tempo real podem também reduzir os custos e poupar tempo, eliminando a necessidade de replicar as placas para as experiências de curso temporal.
Conclusão
Existem muitas opções disponíveis para o ajudar a planear e conceber as suas experiências de saúde celular. A escolha de um ensaio de viabilidade celular ou de citotoxicidade pode ser uma tarefa difícil, mas temos uma variedade de soluções e recursos para apoiar os seus objectivos de investigação. Para obter mais orientações, consulte os Recursos relacionados abaixo. Se necessitar de mais informações ou de ajuda na resolução de problemas do seu ensaio, o nosso experiente Technical Services Scientists está disponível para o ajudar a obter os resultados de que necessita.
Referências
1. Riss, T.L. e Moravec, R.A. (2004) Utilização de pontos finais de ensaios múltiplos para investigar os efeitos do tempo de incubação, da dose de toxina e da densidade de plaqueamento em ensaios de citotoxicidade baseados em células. Assay Drug Dev Technol. 2(1), 51–62.
2. Zhang, J.H., Chung, T.D. e Oldenburg, K.R. (1999) A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen. 4(2), 67–73.
MyGlo™ Reagent Reader
Speed and simplify gold-standard luminescent cell viability assays with a personal, 96-well reagent reader.